Acido cromico
| Acido cromico | |
|---|---|
 | |
| Nome IUPAC | |
| Acido tetraosso cromico (VI) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | H2CrO4 |
| Massa molecolare (u) | 118,01 |
| Numero CAS | |
| Numero EINECS | 231-801-5 |
| PubChem | 24425 |
| SMILES | O[Cr](=O)(=O)O |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
    
| |
| pericolo | |
| Frasi H | 271 - 301+311 - 330 - 314 - 317 - 334 - 335 - 340 - 350 - 361f - 372 - 410 [1] |
| Consigli P | -- |
L'acido cromico è la specie di formula H2CrO4, dove il cromo ha numero di ossidazione +6; si tratta di una specie molto ossidante e corrosiva. È un acido formato per protonazione dello ione cromato, [CrO4]2−, che non può essere isolato in forma pura. Acido cromico è anche il nome comune ma inappropriato usato per il triossido di cromo, CrO3.[2]
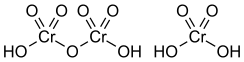
Struttura
[modifica | modifica wikitesto]La struttura della molecola H2CrO4 è basata sulla coordinazione tetraedrica dell'atomo di cromo, ed è rappresentata nel riquadro a fianco. Nel dimero H2Cr2O7 (acido dicromico) due tetraedri sono uniti condividendo un atomo di ossigeno.
Sintesi
[modifica | modifica wikitesto]A differenza dell'ossido CrO3 dal quale formalmente deriva, l'acido cromico non può essere isolato. Di solito è preparato in situ aggiungendo acido solforico concentrato a una soluzione di dicromato, procedura normalmente utilizzata per preparare la miscela cromica. Inizialmente il colore cambia da arancione (ione dicromato) a rosso, segnalando la formazione di acido cromico e acido dicromico. In seguito precipitano cristalli rosso scuro di triossido di cromo (CrO3). Il colore di queste specie è dovuto a bande di assorbimento a transizione di carica di tipo LMCT.
Reattività
[modifica | modifica wikitesto]In H2CrO4 il cromo si trova nel suo massimo stato di ossidazione, +6, e questo conferisce forti proprietà ossidanti alle sue soluzioni. La chimica dell'acido cromico è piuttosto complessa. H2CrO4 è la forma totalmente protonata dello ione cromato, [CrO4]2−, ed esiste solo in soluzione fortemente acida. Non si può isolare a causa di numerosi equilibri acido-base o di condensazione. Per quanto riguarda gli equilibri acido-base, H2CrO4 è per vari aspetti simile all'acido solforico, H2SO4. Entrambi sono considerati acidi forti, anche se solo il primo protone è molto acido:
Il pKa di questo equilibrio non è ben noto, e sono riportati valori compresi tra −0,8 e 1,6.[3] La determinazione della costante a forza ionica zero è complicata dal fatto che metà della dissociazione avviene a pH vicino allo zero, quando la concentrazione del protone è vicina a 1 mol/L. Il secondo protone viene perso a valori di pH compresi tra 4 e 8, e quindi lo ione [HCrO4]− è un acido debole:
La chimica di queste specie è complicata dalla presenza di equilibri che portano alla formazione di specie condensate, a loro volta coinvolte in equilibri acido-base. La specie condensata più semplice è lo ione dicromato che si forma con rilascio di una molecola di acqua:
- 2[HCrO4]− ⇄ [Cr2O7]2− + H2O, log KD = 2,05.
In soluzione acida anche lo ione dicromato può protonarsi fino ad arrivare all'acido dicromico, H2Cr2O7; entrambi i processi possono essere ignorati a pH > 4:[4]
La struttura dell'acido dicromico H2Cr2O7 è rappresentata nel riquadro assieme a H2CrO4.
A seconda del pH si formano anche le specie più condensate [Cr3O10]2− e [Cr4O13]2−. Non si formano invece specie ad alta nuclearità simili ai poliossometallati che si osservano nella chimica di vanadio, molibdeno e tungsteno.[5]
Usi
[modifica | modifica wikitesto]L'acido cromico è una specie che si trova nelle soluzioni usate per le cromature. Si trova anche nella miscela cromica, soluzione fortemente ossidante usata per la pulizia della vetreria nel laboratorio chimico. La miscela cromica è tuttavia sempre meno usata per motivi ambientali.[6] Inoltre la miscela può lasciare tracce di ioni Cr(III) paramagnetici che interferiscono in alcuni tipi di applicazioni come la spettroscopia RMN. In particolare i portacampioni per RMN non vanno lavati con miscela cromica.[7]
Note
[modifica | modifica wikitesto]- ^ Scheda del composto su GESTIS GESTIS-Stoffdatenbank
- ^ (EN) Chromium Trioxide, su chemicalland21.com, Chemical Land21. URL consultato il 23 settembre 2013.
- ^ The IUPAC Stability Constants Database, su acadsoft.co.uk. URL consultato il 16 dicembre 2010 (archiviato dall'url originale il 19 giugno 2017).
- ^ F. Brito, J. Ascanio, S. Mateo, C. Hernández, L. Araujo, P. Gili, P. Martín-Zarza, S. Domínguez e A. Mederos, Equilibria of chromate(VI) species in acid medium and ab initio studies of these species, in Polyhedron, vol. 16, n. 21, pp. 3835–3846, DOI:10.1016/S0277-5387(97)00128-9. URL consultato il 16 dicembre 2010.
- ^ C. E. Housecroft, A. G. Sharpe, Inorganic chemistry, 2ª ed., Harlow (England), Pearson Education Limited, 2005, ISBN 0-13-039913-2.
- ^ J. M. McCormick, Cleaning Glassware, su chemlab.truman.edu. URL consultato il 18 dicembre 2010 (archiviato dall'url originale il 7 dicembre 2008).
- ^ NMR-010: Proper Cleaning Procedures for NMR Sample Tubes, su wilmad-labglass.com. URL consultato il 18 dicembre 2010 (archiviato dall'url originale il 13 maggio 2008).
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido cromico
Wikimedia Commons contiene immagini o altri file su acido cromico
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) chromic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 32179 · LCCN (EN) sh2013000232 · BNE (ES) XX545530 (data) · J9U (EN, HE) 987007600184205171 |
|---|
![{\displaystyle {\ce {[Cr2O7]^2- + 2H+ <=> H2Cr2O7 <=> H2CrO4 + CrO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e32b388975be1ef5636f90b3ad14b46fbd023fb)
![{\displaystyle {\ce {H2CrO4 <=> [HCrO4]- + H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2d77838bc8fc1e7cf53ddc5e16b50c69eea1340)
![{\displaystyle {\ce {[HCrO4]- <=> [CrO4]^2- + H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f66c99245753c659a6fa3be5ce95db3bccc0a603)
![{\displaystyle {\ce {[Cr2O7]^2- + H+ <=> [HCr2O7]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a26f2e11894f4277c987217888ebe67fcdac413)
![{\displaystyle {\ce {[HCr2O7]- + H+ <=> H2Cr2O7}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fdfa92f7888f14535b633951c4ed26114efcaae)
