Clorofilla
| Clorofilla | |
|---|---|
 | |
| Nomi alternativi | |
| Clorofilla | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C55H72O5N4Mg |
| Massa molecolare (u) | 893,49 |
| Aspetto | verde, liquido |
| Numero CAS | (clorofilla a) |
| Numero EINECS | 215-800-7 |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 150 °C - 153 °C |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi H | --- |
| Consigli P | ---[1] |
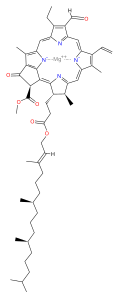
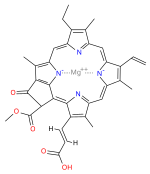
La clorofilla (dal greco χλωρός, chloros = verde e φύλλον, phyllon = foglia) è un pigmento isolato nel 1817 da Joseph Bienaimé Caventou e Pierre-Joseph Pelletier. Di colore verde,[2] è presente nei grani dei cloroplasti delle cellule vegetali, o negli organismi procarioti che realizzano la fotosintesi clorofilliana. La struttura della molecola è caratterizzata dalla presenza di un eterociclo porfirinico, al centro del quale è coordinato uno ione magnesio (l'atomo in verde nell'illustrazione).
Negli eucarioti non sono presenti clorofille, ma considerando quelle dei cianobatteri plastidiali degli archeplastidi ("piante") si potrebbe impropriamente dire siano presenti due diversi tipi di clorofilla:
- la clorofilla a, che assorbe soprattutto la luce blu-violetta e rossa
- la clorofilla b, che assorbe soprattutto la luce blu ed arancione.
Altri pigmenti minoritari sono i carotenoidi, che assorbono un ampio spettro della luce blu e che riflettono la luce arancio.
Le piante appaiono verdi, poiché le lunghezze d'onda del verde sono le meno assorbite dai cianobatteri plastidiali delle piante. Le clorofille degli altri eubatteri (come i cianobatteri a vita libera e molti proteobatteri) sono leggermente diverse.
Struttura molecolare
[modifica | modifica wikitesto]
La clorofilla è una clorina prodotta attraverso lo stesso processo metabolico delle porfirine come l'eme, alle quali è strutturalmente simile. La molecola ha una struttura ad anello, al centro del quale c'è un atomo di magnesio che ha la funzione di mantenere la struttura rigida per evitare che l'energia solare si disperda sotto forma di calore prima che possa essere utilizzata per il processo fotosintetico. Dall'anello poi parte una lunga catena idrofoba o idrorepellente che serve per ancorare la molecola di clorofilla alle membrane tilacoidi. Vi sono alcune forme differenti che avvengono naturalmente, ma la più universalmente diffusa tra le piante terrestri è la clorofilla a, la cui struttura fu decodificata da Hans Fischer nel 1940, e dal 1978, quando la stereochimica della clorofilla a era risaputa, Robert Burns Woodward pubblicò una sintesi completa della molecola com'è ad oggi conosciuta.[3] Nel 1967 le residue delucidazioni stereochimiche furono perfezionate da Ian Fleming[4] e nel 1990 Woodward e coautori pubblicarono una sintesi aggiornata.[5]
Le differenti strutture della clorofilla sono sintetizzate sotto:
| Clorofilla a | Clorofilla b | Clorofilla c1 | Clorofilla c2 | Clorofilla d | |
|---|---|---|---|---|---|
| Formula molecolare | C55H72O5N4Mg | C55H70O6N4Mg | C35H30O5N4Mg | C35H28O5N4Mg | C54H70O6N4Mg |
| Massa molecolare | 893.509 | 907.492 | 610,96 | 608,94 | 893,48 |
| Gruppo C3 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CHO |
| Gruppo C7 | -CH3 | -CHO | -CH3 | -CH3 | -CH3 |
| Gruppo C8 | -CH2CH3 | -CH2CH3 | -CH2CH3 | -CH=CH2 | -CH2CH3 |
| Gruppo C17 | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl | -CH=CHCOOH | -CH=CHCOOH | -CH2CH2COO-Phytyl |
| Legame C17-C18 | Singolo | Singolo | Doppio | Doppio | Singolo |
| Diffusione | Universale | Maggior parte delle piante | Varie alghe | Varie alghe | cianobatteri |
-
Struttura della clorofilla a
-
Struttura della clorofilla b
-
Struttura della clorofilla c1
-
Struttura della clorofilla c2
-
Struttura della clorofilla d
La clorofilla nella fotosintesi
[modifica | modifica wikitesto]

La clorofilla è vitale per la fotosintesi che permette alle piante di ottenere energia dalla luce.
Le molecole di clorofilla sono specificamente posizionate e circondate da complessi proteici chiamati fotosistemi che sono racchiusi nei tilacoidi dei cloroplasti. In questi complessi la clorofilla serve a due funzioni principali. La funzione della gran parte della clorofilla, fino a diverse centinaia per fotosistema, è di assorbire la luce e trasferire l'energia ad una coppia specifica di clorofilla nel centro di reazione del fotosistema. A causa della selettività della clorofilla rispetto alla lunghezza d'onda assorbita, le aree della foglia contenenti la molecola appaiono verdi.
Esistono due tipi di fotosistemi:
- il fotosistema I o P700
- il fotosistema II o P680
"700" e "680" indicano la lunghezza d'onda in nanometri in cui i due diversi accettori primari hanno il loro picco di assorbimento.[6] L'identità, la funzione e le proprietà spettrali dei tipi di clorofilla in ciascun fotosistema sono distinte e determinate da ciascuno e dalla struttura proteica circostante. Una volta estratti dalla proteina in un solvente (come l'acetone o il metanolo), questi pigmenti possono essere separati in un semplice esperimento di carta cromatografica e, sulla base del numero di gruppi polari tra clorofilla a e b, essi saranno chimicamente separati sulla carta.
La funzione del centro di reazione della clorofilla è utilizzare l'energia assorbita e trasferita dall'altra clorofilla nel fotosistema per provocare una separazione di cariche, una specifica reazione di ossidoriduzione in cui la clorofilla dona un elettrone a una serie di intermediari molecolari sulla cosiddetta catena di trasporto degli elettroni. La clorofilla del centro di reazione caricata (P680+) è poi ridotta nuovamente allo stato di equilibrio acquisendo un elettrone. Nel fotosistema II l'elettrone che riduce il P680+ proviene infine dall'ossidazione dell'acqua in O2 e 4H+ ad opera del complesso evolvente ossigeno. Tra l'altro grazie a questa reazione gli organismi fotosintetici producono ossigeno gassoso costituendo la fonte di quasi tutto l'ossigeno presente nell'atmosfera terrestre. Il fotosistema I lavora tipicamente in serie col fotosistema II così il P700+ del fotosistema I è normalmente prodotto dal fotosistema II attraverso intermediari nella membrana tilacoide. Tuttavia le reazioni di trasferimento degli elettroni nella membrana tilacoide sono complessi e la fonte degli elettroni usati per ridurre il P700+ può variare.
Il flusso di elettroni prodotti dalla clorofilla del centro di reazione è usato per trasportare gli ioni H+ attraverso la membrana tilacoide creando un potenziale chemiosmotico usato prettamente per produrre energia chimica da ATP. Quegli elettroni infine riducono il NADP+ in NADPH, un riducente universale utilizzato per ridurre il CO2 in zuccheri come anche per altre riduzioni biosintetiche.
I complessi clorofilla-proteina del centro di reazione sono in grado di assorbire direttamente la luce e produrre separazione di cariche senza altri pigmenti clorofilliani, ma la probabilità di assorbire un fotone sotto una radiazione luminosa data è bassa. Così la clorofilla rimanente nel fotosistema e i complessi antenna pigmento proteina associati col fotosistema assorbono cooperativamente e incanalano l'energia luminosa verso il centro di reazione. Oltre alla clorofilla a vi sono altri pigmenti, chiamati accessori, che intervengono in questi complessi antenna.
Spettrofotometria
[modifica | modifica wikitesto]
La clorofilla, di qualsiasi tipo essa sia, presenta colore verde-giallastro come visibile da una semplice cromatografia su carta. Da un punto di vista fisico questo vuol dire che la clorofilla assorbe tutte le lunghezze d'onda dello spettro visibile tranne quelle in prossimità dei 490-590 nm.
Nel periodo autunnale la concentrazione di clorofilla nel fogliame diminuisce, quindi questo assume una colorazione bruno-rossiccia data dalla presenza dei carotenoidi.
La misurazione dello spettro di assorbimento, ovvero del colore, della clorofilla viene svolta con metodiche di spettrofotometria.
La misura dell'assorbanza della luce è complicata dal solvente utilizzato per estrarre la clorofilla dalla materia vegetale, che influenza i risultati ottenuti;
- Nel dietil etere, la clorofilla a presenta i massimi di assorbimento approssimati a 430 nm e 662 nm, mentre la clorofilla b li presenta a 453 nm e 642 nm.[7]
- I picchi di assorbimento della clorofilla a sono a 665 nm e 465 nm. La clorofilla a diviene fluorescente a 673 nm. Il picco del coefficiente di assorbimento molare della clorofilla a supera 105 M−1 cm−1, che è il più alto tra i composti organici.
Il fatto che la clorofilla a e b abbiano dei spettri di assorbimento differenti si traduce in un migliore assorbimento della radiazione solare per la fotosintesi clorofilliana.
Nella tabella di seguito vengono indicate le lunghezze d'onda in nanometri a cui corrisponde il massimo dei picchi di assorbimento primari e l'estensione dei picchi (indicata tra parentesi):
| Clorofilla a | Clorofilla b | Clorofilla c | Clorofilla d | Clorofilla e | |
|---|---|---|---|---|---|
| Picco 1 | 430 nm | 480 nm | 434 nm | (circa 400-470 nm) | - |
| Picco 2 | 663 nm | 650 nm | 666 nm | 700 nm (700-730 nm) | (715-725 nm) |
I valori indicati sono valori approssimati. Infatti si hanno risultati differenti a seconda che le prove siano fatte in vivo o in vitro e a seconda del solvente utilizzato.
Nel momento in cui le foglie ingialliscono, la clorofilla è convertita in un gruppo di tetrapirroli incolori conosciuti come cataboliti influorescenti della clorofilla (NCC's). Questi composti sono anche stati identificati in vari frutti maturi.[8]
Biosintesi
[modifica | modifica wikitesto]Nelle piante la clorofilla viene sintetizzata a partire dal succinil-CoA e dalla glicina, nonostante l'immediato precursore della clorofilla a e b sia la protoclorofilla.
La clorosi è una condizione in cui le foglie non producono clorofilla sufficiente, divenendo gialle. La clorosi può essere causata da deficienze alimentari, tra cui quella di ferro e in misura minore di magnesio e di azoto. Il pH del suolo talvolta gioca un ruolo nella clorosi alimentare: molte piante si sono adattate a crescere in terreni con specifici pH e la loro capacità di assorbire dal suolo i nutrienti può dipendere dal pH dello stesso.[9] La clorosi può anche essere causata da organismi patogeni come virus, batteri e funghi o parassiti che succhiano la linfa.
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 10.10.2012
- ^ per una spiegazione scientifica sul colore verde della clorofilla, vedere la sezione "Spettrofotometria".
- ^ R. B. Woodward, W. A. Ayer, J. M. Beaton, F. Bickelhaupt, R. Bonnett, P. Buchschacher, G. L. Closs, H. Dutler, J. Hannah, F. P. Hauck, S. Itô, A. Langemann, E. Le Goff, W. Leimgruber, W. Lwowski, J. Sauer, Z. Valenta, and H. Volz, The total synthesis of chlorophyll, in Journal of the American Chemical Society, vol. 82, 1960, pp. 3800-3802, DOI:10.1021/ja01499a093.
- ^ Ian Fleming, Absolute Configuration and the Structure of Chlorophyll, in Nature, vol. 216, ottobre 1967, pp. 151–152, DOI:10.1038/216151a0.
- ^ Robert Burns Woodward, William A. Ayer, John M. Beaton, Friedrich Bickelhaupt, Raymond Bonnett, Paul Buchschacher, Gerhard L. Closs, Hans Dutler, John Hannah, Fred P. Hauck, et al., The total synthesis of chlorophyll a, in Tetrahedron, vol. 465378, n. 22, 1990, pp. 7599-7659, DOI:10.1016/0040-4020(90)80003-Z.
- ^ Green, 1984
- ^ Gross, 1991
- ^ (EN) Thomas Müller, Markus Ulrich e Karl-Hans Ongania, Colorless Tetrapyrrolic Chlorophyll Catabolites Found in Ripening Fruit Are Effective Antioxidants, in Angewandte Chemie International Edition, vol. 46, n. 45, 19 novembre 2007, pp. 8699–8702, DOI:10.1002/anie.200703587.
- ^ (EN) Iron Chlorosis in Turfgrass
Bibliografia
[modifica | modifica wikitesto]- Biochemistry, L. Stryer (W.H. Freeman and Co, San Francisco, 1975)
- Introduction to Organic Chemistry, Streitweiser and Heathcock (MacMillan, New York, 1981)
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «clorofilla»
Wikizionario contiene il lemma di dizionario «clorofilla» Wikimedia Commons contiene immagini o altri file su clorofilla
Wikimedia Commons contiene immagini o altri file su clorofilla
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) chlorophyll, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Chlorophyl d: the puzzle resolved (PDF), su mbl.ku.dk. URL consultato il 18 giugno 2021 (archiviato dall'url originale il 13 marzo 2012).
| Controllo di autorità | Thesaurus BNCF 12914 · LCCN (EN) sh85024579 · GND (DE) 4147817-4 · BNF (FR) cb120073259 (data) · J9U (EN, HE) 987007285766705171 · NDL (EN, JA) 00574346 |
|---|