Emangioma infantile
L'emangioma infantile è un tipo di tumore vascolare benigno che colpisce i bambini.[1][2] Appare come una lesione rossa o blu in rilievo sulla pelle.[3] In genere si manifestano durante le prime quattro settimane di vita, crescono fino a circa cinque mesi di vita, quindi si riducono di dimensioni e scompaiono negli anni successivi.[1][2] Spesso cambiamenti della pelle rimangono dopo che si sono ridotti.[1][4] Le complicazioni possono includere dolore, sanguinamento, formazione di ulcere, insufficienza cardiaca o problemi estetici.[1]
La ragione alla base del loro verificarsi non è chiara.[1] In circa il 10% dei casi sembrano essere congeniti.[1] Alcuni casi sono associati ad altre anomalie come la sindrome PHACE.[1] La diagnosi si basa generalmente sui sintomi e sull'aspetto.[1] Occasionalmente l'imaging medico può aiutare nella diagnosi.[1]
Nella maggior parte dei casi non è necessario alcun trattamento, se non un'attenta osservazione.[1][4] Alcuni casi, tuttavia, possono causare problemi e si consiglia l'uso di farmaci come propranololo o steroidi.[1][4] Occasionalmente può essere utilizzato un intervento chirurgico o un trattamento laser.[1]
È uno dei tumori benigni più comuni nei bambini, che si verifica in circa il 5% dei nascituri.[1][4] Si verificano più frequentemente nelle femmine, nei caucasici, nei prematuri e nei bambini con basso peso alla nascita.[1] La parola "emangioma" deriva dal greco haima (αἷμα) che significa "sangue"; angeion (ἀγγεῖον) che significa "vaso"; e -oma (-ωμα) che significa "tumore".[5]
Segni e sintomi
[modifica | modifica wikitesto]


Gli emangiomi infantili si sviluppano tipicamente nelle prime settimane o mesi di vita.[7] Sono più comuni nei caucasici, nei bambini prematuri il cui peso alla nascita è inferiore a 3 libbre (1,4 kg), nelle femmine e in occasione di parti gemellari.[8] Le lesioni precoci possono assomigliare a un graffio o una macchia rossa, una macchia bianca o un livido. La maggior parte si verifica sulla testa e sul collo, ma possono verificarsi quasi ovunque. L'aspetto e il colore dell'emangioma infantile dipendono dalla sua posizione e profondità all'interno della pelle.[7]
Gli emangiomi infantili superficiali sono situati più in alto nella pelle e hanno un aspetto rosso vivo, da eritematoso a rosso porpora. Le lesioni superficiali possono essere piatte e teleangectasiche, costituite da una macula o da una chiazza di vasi sanguigni capillari, piccoli e variamente ramificati. Possono anche essere sollevati ed elevati dalla pelle, formando papule e placche rosso vivo confluenti come isole rialzate.
Gli emangiomi infantili superficiali in determinate posizioni come il cuoio capelluto posteriore, le pieghe del collo e le aree inguinali/perianali sono a potenziale rischio di ulcerazione. Gli emangiomi ulcerati possono presentarsi come papule o placche crostose nere, erosioni o ulcere dolorose. Le ulcerazioni sono soggette a infezioni batteriche secondarie, che possono presentarsi con croste gialle, drenaggio, dolore o odore. Le ulcerazioni sono anche a rischio di sanguinamento, in particolare lesioni profonde o in aree di attrito. Emangiomi superficiali multipli possono essere associati a emangiomi extracutanei, il più comune è un emangioma epatico (epatico), e questi neonati richiedono un esame ecografico.[7]
Gli emangiomi infantili profondi si presentano come macule bluastre poco definite che possono proliferare in papule, noduli o tumori più grandi. Le lesioni proliferanti sono spesso comprimibili, ma abbastanza solide. Molti emangiomi profondi possono avere pochi capillari superficiali visibili evidenti sopra la componente profonda primaria o la prominenza venosa circostante. Gli emangiomi profondi hanno la tendenza a svilupparsi un po' più tardi degli emangiomi superficiali e possono avere anche fasi proliferative più lunghe e successive. Gli emangiomi profondi raramente si ulcerano, ma possono causare problemi a seconda della loro posizione, dimensione e crescita. Gli emangiomi profondi vicino alle strutture sensibili possono causare la compressione delle strutture circostanti più morbide durante la fase proliferativa, come il condotto uditivo esterno e la palpebra.[7] Gli emangiomi misti sono semplicemente una combinazione di emangiomi superficiali e profondi e potrebbero non essere evidenti per diversi mesi. I pazienti possono avere qualsiasi combinazione di emangiomi infantili superficiali, profondi o misti.
Gli emangiomi infantili sono spesso classificati come focali/localizzati, segmentali o indeterminati. Gli emangiomi infantili focali appaiono localizzati in una posizione specifica e sembrano sorgere da un punto solitario. Gli emangiomi segmentali sono più grandi e sembrano comprendere una regione del corpo. Emangiomi più grandi o segmentali che si estendono su una vasta area possono talvolta avere anomalie sottostanti che possono richiedere indagini ulteriori, specialmente se localizzate sul viso, presso l'osso sacro o sul bacino.
A meno che non si verifichi un'ulcerazione, un emangioma infantile non tende a sanguinare e non è doloroso. Può insorgere disagio se è ingombrante e blocca un orifizio vitale.[7][8][9][10][11]
-
Emangioma sulla fronte che mostra segni di regressione precoce
-
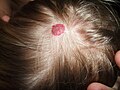
Emangioma sul cuoio capelluto di un bambino di 2 anni, in "fase di riposo"
-
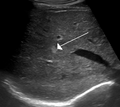
Emangioma del fegato visto con l'ecografia
-
Un emangioma epatico come visto alla TC
Complicazioni
[modifica | modifica wikitesto]Quasi nessun'emangioma infantile è associato a complicazioni. Possono rompersi in superficie avendosi così ulcerazioni che possono essere dolorose e problematiche. Se l'ulcerazione è profonda, in rare occasioni possono verificarsi emorragie e infezioni significative. Se si sviluppa un emangioma nella laringe, la respirazione può essere compromessa. Se localizzato vicino all'occhio, un emangioma in crescita può causare un'occlusione o una deviazione dell'occhio che può portare all'ambliopia.[12] Molto raramente emangiomi estremamente grandi possono causare insufficienza cardiaca ad alta gittata a causa della quantità di sangue che deve essere pompata nei vasi sanguigni in eccesso. Lesioni adiacenti all'osso possono causare l'erosione dell'osso.[7]
I problemi più frequenti negli emangiomi infantili derivano da complicazioni psicosociali. La condizione può influenzare l'aspetto di una persona e provocare attenzione e reazioni negative da parte degli altri. Problemi particolari si verificano se sono coinvolti il labbro o il naso, poiché le distorsioni possono essere difficili da trattare chirurgicamente. Il potenziale di danno psicologico si sviluppa dall'età scolare in poi. Considerare il trattamento prima dell'inizio della scuola è quindi importante se non si è verificato un adeguato miglioramento spontaneo. Emangiomi infantiligrandi possono lasciare cambiamenti della pelle secondari visibili a causa di un forte stiramento che si traduce in un'alterazione della struttura superficiale.
Gli emangiomi segmentari di grandi dimensioni del distretto testa-collo possono essere associati a un disturbo chiamato sindrome FACES.[13][14] Grandi emangiomi segmentali sopra la colonna lombare possono essere associati a disrafismo, problemi renali e urogenitali in associazione con un disturbo chiamato sindrome lombare. Emangiomi cutanei multipli nei neonati possono essere un indicatore di emangiomi epatici. Lo screening per il coinvolgimento epatico è spesso raccomandato nei bambini con cinque o più emangiomi cutanei.[15]
Cause
[modifica | modifica wikitesto]La causa dell'emangioma è attualmente sconosciuta, ma diversi studi hanno suggerito l'importanza delle vie di segnalazione degli estrogeni in proliferazione. Lo stimolo può essere un'ipossia localizzata dei tessuti molli associata a un aumento degli estrogeni circolanti dopo la nascita.[16] Inoltre, i ricercatori hanno presentato un'ipotesi secondo cui la placenta materna embolizza nel derma fetale durante la gestazione, con conseguente emangiomagenesi.[17][18] Tuttavia un altro gruppo di ricercatori ha condotto analisi genetiche del polimorfismo a singolo nucleotide nel tessuto dell'emangioma rispetto al DNA della madre che contraddiceva questa ipotesi.[19] Altri studi hanno rivelato il ruolo dell'aumento dell'angiogenesi e della vasculogenesi nell'eziologia degli emangiomi.[20]
Diagnosi
[modifica | modifica wikitesto]
La maggior parte degli emangiomi infantili può essere diagnosticata nell'anamnesi e nella visita medica.[21] In rari casi sono necessarie immagini (ecografia con Doppler, risonanza magnetica) e/o citologia o istopatologia per confermare la diagnosi.[22][23] Gli emangiomi infantili sono generalmente assenti alla nascita o si può osservare una piccola area di pallore, teleangectasie o oscurità. Una massa completamente formata alla nascita di solito indica una diagnosi diversa da emangioma infantile. Gli emangiomi superficiali nel derma superiore hanno un colore rosso fragola brillante, mentre quelli nel derma profondo e nel sottocute, emangiomi profondi, possono apparire blu ed essere sodi o gommosi alla palpazione. Gli emangiomi misti possono avere entrambe le caratteristiche.[21] Un emangioma infantile minimamente proliferativo è un tipo raro che si presenta con teleangectasie maculari fini e occasionalmente con una componente proliferativa, papulare, di colore rosso vivo. Gli emangiomi infantili minimamente proliferativi sono più comuni nella parte inferiore del corpo.[24]
Una storia precisa delle caratteristiche di crescita dell'emangioma infantile può essere molto utile per fare la diagnosi. Nelle prime 4-8 settimane di vita, gli emangiomi infantili crescono rapidamente con una crescita principalmente volumetrica piuttosto che radiale. Ciò è solitamente seguito da un periodo di crescita più lenta che può durare 6-9 mesi, con l'80% della crescita completata entro 3 mesi. Infine, gli emangiomi infantili si evolvono per un periodo di anni.[25] Le eccezioni a queste caratteristiche di crescita includono gli emangiomi infantili minimamente proliferativi, che sostanzialmente non proliferano[24] e gli emangiomi infantili grandi e profondi in cui una crescita evidente inizia più tardi e dura più a lungo.[25] Se la diagnosi non è chiara in base alla visita medica e all'anamnesi di crescita (più spesso negli emangiomi profondi con scarso coinvolgimento cutaneo), l'imaging o l'istopatologia possono aiutare a confermare la diagnosi.[22][26] All'ecografia Doppler, un emangioma infantile in fase proliferativa appare come una massa di tessuto molle ad alto flusso solitamente senza shunt arterovenoso diretto. Alla risonanza magnetica, gli emangiomi infantili mostrano una lesione ben circoscritta con intensità del segnale intermedia e aumentata rispettivamente su sequenze T1 e T2 e forte miglioramento dopo iniezioni di gadolinio, in vasi a flusso rapido.[22] Il tessuto per la diagnosi può essere ottenuto tramite agoaspirato, biopsia cutanea o biopsia escissionale.[27] Al microscopio, gli emangiomi infantili sono aggregati non incapsulati di capillari a parete sottile e ravvicinati, solitamente con rivestimento endoteliale. I vasi sanguigni sono separati da scarso tessuto connettivo. Il loro lume può essere trombizzato e organizzato. Si può osservare la deposizione di pigmento emosiderina a causa della rottura del vaso.[28] Il marcatore istochimico GLUT-1 può essere utile per distinguere gli emangiomi infantili da altri elementi in diagnosi differenziale, come le malformazioni vascolari.[23]
Terapia
[modifica | modifica wikitesto]La maggior parte degli emangiomi infantili scompare senza trattamento, lasciando segni minimi o non visibili. Tuttavia ciò può richiedere molti anni e una parte delle lesioni può richiedere una qualche forma di terapia.[29] Recentemente sono state pubblicate linee guida multidisciplinari di pratica clinica per la gestione degli emangiomi infantili.[30] Le indicazioni per il trattamento includono problemi funzionali (per es. problemi alla vista o nell'alimentazione), sanguinamento, complicanze potenzialmente pericolose per la vita (malattie delle vie aeree, cardiache o epatiche) e rischio di problemi estetici a lungo termine o permanenti.[31] Quando interferiscono con la vista, la respirazione o minacciano una deturpazione significativa (in particolare lesioni facciali e, in particolare, naso e labbra), vengono solitamente trattati. Le terapie mediche sono più efficaci se utilizzate durante il periodo più significativo di crescita dell'emangioma, che corrisponde ai primi 5 mesi di vita.[25] Gli emangiomi ulcerati, un sottogruppo di lesioni che richiedono terapia, vengono solitamente trattati rivolgendo l'attenzione alla cura delle ferite, al dolore e alla crescita dell'emangioma.[32]
Farmacoterapia
[modifica | modifica wikitesto]Le opzioni di trattamento per gli emangiomi infantili includono terapie mediche (sistemiche, intralesionali e topiche), chirurgia e terapia laser. Prima del 2008, il cardine della terapia per gli emangiomi problematici erano i corticosteroidi orali, che sono efficaci e rimangono un'opzione per i pazienti in cui la terapia con betabloccanti è controindicata o mal tollerata.[33][34][35] A seguito della fortuita osservazione che il propranololo, un betabloccante non selettivo, è ben tollerato ed efficace per il trattamento degli emangiomi,[36][37] l'agente è stato studiato in un ampio studio randomizzato e controllato[38] ed è stato approvato dalla US Food e Drug Administration per questa indicazione nel 2014.[39] Il propranololo è successivamente diventato la terapia medica sistemica di prima linea per il trattamento di queste lesioni.[31]
Da quel momento, il timololo maleato topico oltre al propranalolo orale è diventato una terapia comune per gli emangiomi infantili. Secondo una Cochrane review del 2018,[40] entrambe queste terapie hanno dimostrato effetti benefici in termini di eliminazione degli emangiomi senza un aumento dei danni. Inoltre, non è stata rilevata alcuna differenza tra questi due agenti e la loro capacità di ridurre le dimensioni dell'emangioma; tuttavia, non è chiaro se esista una differenza in termini di sicurezza. Tutti questi risultati erano basati su evidenze di qualità da moderata a bassa, quindi sono necessari ulteriori studi randomizzati e controllati con ampie popolazioni di bambini per valutare ulteriormente queste terapie. Questa review ha concluso che per ora nessuna prova mette in discussione il propranalolo orale come terapia sistemica standard per il trattamento di queste lesioni.
Altre terapie sistemiche che possono essere efficaci per il trattamento dell'emangioma infantile includono vincristina, interferone e altri agenti con proprietà antiangiogeniche. La vincristina, che richiede l'accesso venoso centrale per la somministrazione, è tradizionalmente utilizzata come agente chemioterapico, ma è stata dimostrata l'efficacia contro gli emangiomi e altri tumori vascolari infantili, come l'emangioendotelioma kaposiforme e l'angioma "a ciuffi".[41][42] L'interferone alfa 2a e 2b, somministrato per iniezione sottocutanea, ha mostrato efficacia contro gli emangiomi,[43] ma può provocare diplegia spastica fino al 20% dei bambini trattati.[44][45] Questi agenti sono usati raramente ora nell'era della terapia con betabloccanti.
L'iniezione intralesionale di corticosteroidi (di solito triamcinolone) è stata utilizzata per piccoli emangiomi localizzati, dove è stato dimostrato che è relativamente sicuro ed efficace.[46][47] L'iniezione di emangiomi della palpebra superiore è controversa, dato il rischio riportato di embolizzazione retinica, probabilmente correlato a pressioni di iniezione elevate.[48][49] Il timololo maleato topico, un betabloccante non selettivo disponibile in una soluzione gelificante approvata per il trattamento del glaucoma, è stato sempre più riconosciuto come un'alternativa off-label sicura ed efficace per il trattamento di piccoli emangiomi.[50][51][52] Viene generalmente applicato due o tre volte al giorno.[53]
Chirurgia
[modifica | modifica wikitesto]La resezione chirurgica degli emangiomi è raramente indicata e limitata a lesioni che falliscono la terapia medica (o quando è controindicata), che sono anatomicamente distribuite in una posizione suscettibile di resezione e in cui sarebbe probabilmente necessaria la resezione e la cicatrice sarebbe simili indipendentemente dalla tempistica dell'intervento.[31][54] La chirurgia può essere utile anche per la rimozione del tessuto fibroadiposo residuo (dopo l'involuzione dell'emangioma) e la ricostruzione delle strutture danneggiate.
Laser
[modifica | modifica wikitesto]La terapia laser, il più delle volte il laser a colorante pulsato (PDL), svolge un ruolo limitato nella gestione dell'emangioma.[55] Il PDL è più spesso usato per il trattamento degli emangiomi ulcerati, spesso in combinazione con terapie topiche e cura delle ferite, e può accelerare la guarigione e diminuire il dolore.[56][57] La laserterapia può essere utile anche per gli emangiomi infantili superficiali precoci (sebbene le lesioni a rapida proliferazione possano essere più soggette a ulcerazione dopo il trattamento con PDL) e per il trattamento delle teleangectasie cutanee che persistono dopo l'involuzione.[58][59]
Prognosi
[modifica | modifica wikitesto]Nella fase di involuzione, un emangioma infantile inizia finalmente a diminuire di dimensioni. Mentre in precedenza si pensava che gli emangiomi infantili migliorassero di circa il 10% ogni anno, prove più recenti suggeriscono che il miglioramento e l'involuzione massimi vengono generalmente raggiunti entro i 3,5 anni di età.[60][61] La maggior parte degli emangiomi infantili si risolve entro i 10 anni, ma in alcuni pazienti l'emangioma non si risolve completamente. Si può notare arrossamento residuo che può essere migliorato con la terapia laser.[62] Il resurfacing ablativo frazionato può essere preso in considerazione per i cambiamenti strutturali della pelle.[63] Gli emangiomi, specialmente quelli che sono diventati molto grandi durante la fase di crescita, possono lasciare la pelle allungata o il tessuto fibroadiposo che può essere sfigurante o richiedere una futura correzione chirurgica. Le aree di precedente ulcerazione possono lasciare cicatrici permanenti.
Ulteriori sequele a lungo termine derivano dall'identificazione di manifestazioni extracutanee in associazione con l'emangioma infantile. Ad esempio, un paziente con un ampio emangioma facciale che soddisfa i criteri per la sindrome PHACE richiederà potenzialmente un monitoraggio neurologico, cardiaco e/o oftalmologico. Nei casi di emangioma infantile che compromettono le strutture vitali, i sintomi possono migliorare con l'involuzione dell'emangioma. Ad esempio, lo stress respiratorio migliorerebbe con l'involuzione di un emangioma infantile occupante spazio che coinvolge le vie aeree e l'insufficienza cardiaca ad alta gittata potrebbe diminuire con l'involuzione di un emangioma epatico e, infine, il trattamento potrebbe essere ridotto o interrotto. In altri casi, come un emangioma palpebrale non trattato, l'ambliopia risultante non migliora con l'involuzione della lesione cutanea. Per questi motivi, i bambini con emangiomi infantili dovrebbero essere valutati da un medico appropriato durante la fase proliferativa iniziale in modo che il monitoraggio e il trattamento del rischio siano individualizzati e gli esiti possano essere ottimizzati.[25][64]
Terminologia
[modifica | modifica wikitesto]La terminologia utilizzata per definire, descrivere e classificare i tumori e le malformazioni vascolari è cambiata nel tempo. Il termine emangioma era originariamente usato per descrivere qualsiasi struttura simile a un tumore vascolare, sia che fosse presente alla nascita o intorno alla nascita o che apparisse più tardi nella vita. Nel 1982 Mulliken e Glowacki hanno proposto un nuovo sistema di classificazione per le anomalie vascolari che è stato ampiamente accettato e adottato dalla International Society for the Study of Vascular Anomalies (ISSVA).[65] Questo sistema di classificazione è stato recentemente aggiornato nel 2018.[66] La classificazione delle anomalie vascolari si basa ora sulle caratteristiche cellulari, sulla storia naturale e sul comportamento clinico della lesione. Le anomalie vascolari sono suddivise in tumori vascolari (che includono gli emangiomi infantili) e malformazioni vascolari (che includono le malformazioni capillari, le malformazioni venose e le malformazioni linfatiche).[66] Nel 2000, GLUT-1, un marcatore immunoistochimico specifico, è risultato positivo negli emangiomi infantili e negativo in altri tumori o malformazioni vascolari.[23][26][67] Questo marker ha rivoluzionato la capacità di distinguere tra emangioma infantile e altre anomalie vascolari.[26][68]
Note
[modifica | modifica wikitesto]- ^ a b c d e f g h i j k l m n Diagnosis and Management of Infantile Hemangioma, in Pediatrics, vol. 136, n. 4, ottobre 2015, pp. e1060-104, DOI:10.1542/peds.2015-2485, PMID 26416931.
- ^ a b (EN) nhs.uk, https://www.nhs.uk/conditions/birthmarks/. URL consultato il 16 aprile 2021.
- ^ Merck Manuals Professional Edition, https://www.merckmanuals.com/professional/dermatologic-disorders/benign-skin-tumors,-growths,-and-vascular-lesions/infantile-hemangiomas. URL consultato il 7 gennaio 2019.
- ^ a b c d Clinical Practice Guideline for the Management of Infantile Hemangiomas, in Pediatrics, vol. 143, n. 1, gennaio 2019, pp. e20183475, DOI:10.1542/peds.2018-3475, PMID 30584062.
- ^ (EN) Lexicon Orthopaedic Etymology, CRC Press, 1999, p. 16, ISBN 9789057025976.
- ^ Cutaneous lesions of the nose., in Head & Face Medicine, vol. 6, 4 giugno 2010, p. 7, DOI:10.1186/1746-160X-6-7, PMID 20525327.
- ^ a b c d e f Drolet BA, Esterly NB, Frieden IJ, Hemangiomas in Children, in New England Journal of Medicine, vol. 341, n. 3, 1999, pp. 173–181, DOI:10.1056/nejm199907153410307, PMID 10403856.
- ^ a b Haggstrom AN, Drolet BA, Baselga E, "Prospective study of infantile hemangiomas" demographic, prenatal, and perinatal characteristics, in J Pediatr, vol. 150, n. 3, 2007, pp. 291–294, DOI:10.1016/j.jpeds.2006.12.003, PMID 17307549.
- ^ lacolon.com, http://www.lacolon.com/patient-education/gi-associated-hemangiomas-and-vascular-malformations.
- ^ cincinnatichildrens.org, http://www.cincinnatichildrens.org/health/h/hemangioma/.
- ^ Oakley, Amanda. "Infantile haemangioma.". DermNet NZ. Retrieved February 11, 2013.
- ^ Hunzeker C, Geronemus R (2010). Treatment of Superficial Infantile Hemangiomas of the Eyelid Using the 595-nm Pulsed Dye Laser". Dermatol. Surg. 36 (5): 590–597.
- ^ Oza VS, Wang E, Berenstein A, PHACES association: a neuroradiologic review of 17 patients, in AJNR Am J Neuroradiol, vol. 29, n. 4, 2008, pp. 807–13, DOI:10.3174/ajnr.a0937, PMID 18223093.
- ^ Heyer GL, Dowling MM, Licht DJ, The cerebral vasculopathy of PHACES syndrome, in Stroke, vol. 39, n. 2, 2008, pp. 308–16, DOI:10.1161/strokeaha.107.485185, PMID 18174492.
- ^ Horii KA, Drolet BA, Frieden IJ, Baselga E, Chamlin SL, Haggstrom AN, Holland KE, Mancini AJ, McCuaig CC, Metry DW, Morel KD, Newell BD, Nopper AJ, Powell J, Garzon MC, Prospective study of the frequency of hepatic hemangiomas in infants with multiple cutaneous infantile hemangiomas, in Pediatr Dermatol, vol. 28, n. 3, 2011, pp. 245–53, DOI:10.1111/j.1525-1470.2011.01420.x, PMID 21517952.
- ^ Kleinman ME, Greives MR, Churgin SS, "(December 2007). "Hypoxia-induced mediators of stem/progenitor cell trafficking are increased in children with hemangioma, in Arterioscler. Thromb. Vasc. Biol., vol. 27, n. 12, dicembre 2007, pp. 2664–70, DOI:10.1161/ATVBAHA.107.150284, PMID 17872454.
- ^ Barnés CM, Huang S, Kaipainen A, Evidence by molecular profiling for a placental origin of infantile hemangioma, in Proc. Natl. Acad. Sci. U.S.A., vol. 102, n. 52, 2005, pp. 19097–102, DOI:10.1073/pnas.0509579102, PMID 16365311.
- ^ North PE, Waner M, Brodsky MC, Are infantile hemangiomas of placental origin?, in Ophthalmology, vol. 109, n. 4, 2002, pp. 633–4, DOI:10.1016/S0161-6420(02)01071-0, PMID 11949625.
- ^ Pittman KM, Losken HW, Kleinman ME, "(November 2006). "No evidence for maternal-fetal microchimerism in infantile hemangioma: a molecular genetic investigation, in J. Invest. Dermatol., vol. 126, n. 11, novembre 2006, pp. 2533–8, DOI:10.1038/sj.jid.5700516, PMID 16902414.
- ^ Greenberger SA, Bischoff, Pathogenesis of Infantile Hemangioma, in British Journal of Dermatology, vol. 169, n. 1, Jul 2013, pp. 12–9, DOI:10.1111/bjd.12435, PMID 23668474.
- ^ a b Chiller KG, Passaro D, Frieden IJ, Hemangiomas of infancy: clinical characteristics, morphologic subtypes, and their relationship to race, ethnicity, and sex, in Arch Dermatol, vol. 138, n. 12, 2002, pp. 1567–1576, DOI:10.1001/archderm.138.12.1567, PMID 12472344.
- ^ a b c Dubois J, Alison M, Vascular anomalies: what a radiologist needs to know, in Pediatr Radiol, vol. 40, n. 6, pp. 895–905, DOI:10.1007/s00247-010-1621-y, PMID 20432007.
- ^ a b c North PE, Waner M, Mizeracki A, Mihm MC Jr, GLUT1: a newly discovered immunohistochemical marker for juvenile hemangiomas, in Hum Pathol, vol. 31, n. 1, pp. 11–22, DOI:10.1016/s0046-8177(00)80192-6, PMID 10665907.
- ^ a b Suh KY, Frieden IJ, Infantile hemangiomas with minimal or arrested growth: A retrospective case series, in Arch Dermatol, vol. 146, n. 9, pp. 971–6, DOI:10.1001/archdermatol.2010.197, PMID 20855695.
- ^ a b c d Chang LC, Haggstrom AN, Drolet BA, Baselga E, Chamlin SL, Garzon MC, Horii KA, Lucky AW, Mancini AJ, Metry DW, Nopper AJ, Frieden IJ, vol. 122, 2008, DOI:10.1542/peds.2007-2767, PMID 18676554, https://oadoi.org/10.1542/peds.2007-2767.
- ^ a b c North PE, Mihm MC Jr, vol. 9, 2001, PMID 17590939.
- ^ Erhardt CA, Vesoulis Z, Kashkari S, vol. 44, 2000, DOI:10.1159/000328604, PMID 11127741, https://oadoi.org/10.1159/000328604.
- ^ Kumar Vinay: Robbins and Coltran pathologic basis of disease 8ed. pp. 520-521 Philadelphia: Saunders Elsevier, 2010. ISBN 978-0-8089-2402-9
- ^ Haggstrom, Prospective study of infantile hemangiomas: clinical characteristics predicting complications and treatment., in Pediatrics, vol. 118, n. 3, pp. 882–7, DOI:10.1542/peds.2006-0413, PMID 16950977.
- ^ Krowchuk, Clinical Practice Guideline for the Management of Infantile Hemangiomas, in Pediatrics, vol. 143, n. 1, DOI:10.1542/peds.2018-3475, PMID 30584062.
- ^ a b c Darrow DH, Greene AK, Mancini AJ, Diagnosis and management of infantile hemangioma, in Pediatrics, vol. 136, n. 4, 2015, pp. e1060–1104, DOI:10.1542/peds.2015-2485, PMID 26416931.
- ^ Kim HJ, Colombo M, Frieden IJ, Ulcerated hemangiomas: clinical characteristics and response to therapy, in J Am Acad Dermatol, vol. 44, n. 6, 2001, pp. 962–72, DOI:10.1067/mjd.2001.112382, PMID 11369908.
- ^ Bennett ML, Fleischer AB, Chamlin SL, "Oral corticosteroid use is effective for cutaneous hemangiomas " an evidence-based evaluation, in Arch Dermatol, vol. 137, n. 9, 2001, pp. 1208–13, DOI:10.1001/archderm.137.9.1208, PMID 11559219.
- ^ Sadan N, Wolach B, Treatment of hemangiomas of infants with high doses of prednisone, in J Pediatr, vol. 128, n. 1, 1996, pp. 141–6, DOI:10.1016/s0022-3476(96)70446-8, PMID 8551406.
- ^ Greene AK, Couto RA, Oral prednisolone for infantile hemangioma: efficacy and safety using a standardized treatment protocol, in Plast Reconstr Surg, vol. 128, n. 3, 2011, pp. 743–52, DOI:10.1097/prs.0b013e3182221398, PMID 21572374.
- ^ Leaute-Labreze C, Dumas, de la Roque E, Hubiche T, Propranolol for severe hemangiomas of infancy, in N Engl J Med, vol. 358, n. 24, 2008, pp. 2649–51, DOI:10.1056/nejmc0708819, PMID 18550886.
- ^ Hogeling M et al. (2011) "A randomized controlled trial of propranolol for infantile hemangiomas". Pediatrics 128 (2): e259–e266.
- ^ Leaute-Labreze C, Hoeger P, Mazereeuw-Hautier J, A randomized, controlled trial of oral propranolol in infantile hemangioma, in N Engl J Med, vol. 372, n. 8, 2015, pp. 735–46, DOI:10.1056/NEJMoa1404710, PMID 25693013.
- ^ United States Food and Drug Administration. http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/205410s000lbl.pdf; accessed 9/29/15.
- ^ Novoa M, Baselga E, Beltran S, Giraldo L, Shahbaz A, Pardo-Hernandez H, Arevalo-Rodriguez I, Interventions for infantile haemangiomas of the skin, in Cochrane Database of Systematic Reviews, vol. 2018, n. 4, 2018, DOI:10.1002/14651858.CD006545.pub3, PMID 29667726.
- ^ Perez Payarols J, Pardo Masferrer J, Gomez Bellvert C, Treatment of life-threatening infantile hemangiomas with vincristine, in N Engl J Med, vol. 333, n. 1, 1995, DOI:10.1056/nejm199507063330120, PMID 7777010.
- ^ Enjolras O, Breviere GM, Roger G, Vincristine treatment for function- and life-threatening infantile hemangioma, in Arch Pediatr, vol. 11, n. 2, 2004, DOI:10.1016/j.arcped.2003.10.014, PMID 14761730.
- ^ Wilson MW, Hoehn ME, Haik BG, Rieman M, Reiss U, Low-dose cyclophosphamide and interferon alfa 2a for the treatment of capillary hemangioma of the orbit, in Ophthalmology, vol. 114, n. 5, 2007, DOI:10.1016/j.ophtha.2006.11.031, PMID 17337066.
- ^ Barlow CF, Priebe CJ, Mulliken JB, et al. Spastic diplegia as a complication of interferon alfa-2a treatment of hemangiomas of infancy. J Pediatr 1998;132(3 pt 1):527-30.
- ^ Worle H, Maass E, Kohler B, Interferon alpha-2a therapy in haemangiomas of infancy: spastic diplegia as a severe complication, in Eur J Pediatr, vol. 158, n. 4, 1999, DOI:10.1007/s004310051089, PMID 10206141.
- ^ Chen MT, Yeong EK, Horng SY, Intralesional corticosteroid therapy in proliferating head and neck hemangiomas: a review of 155 cases, in J Pediatr Surg, vol. 35, n. 3, 2000, pp. 420–3, DOI:10.1016/s0022-3468(00)90205-7, PMID 10726680.
- ^ Chantharatanapiboon W. Intralesional corticosteroid therapy in hemangiomas: clinical outcome in 160 cases. J Med Assoc Thai 2008;91(suppl 3):S90-6.
- ^ Ruttum MS, Abrams GW, Harris GJ, Bilateral retinal embolization associated with intralesional corticosteroid injection for capillary hemangioma of infancy, in J Pediatr Ophthalmol Strabismus, vol. 30, n. 1, 1993, pp. 4–7, DOI:10.3928/0191-3913-19930101-03, PMID 8455125.
- ^ Egbert JE, Schwartz GS, Walsh AW, Diagnosis and treatment of an ophthalmic artery occlusion during an intralesional injection of corticosteroid into an eyelid capillary hemangioma, in Am J Ophthalmol, vol. 121, n. 6, 1996, pp. 638–42, DOI:10.1016/s0002-9394(14)70629-4, PMID 8644806.
- ^ Moehrle M, Leaute-Labreze C, Schmidt V, Topical timolol for small hemangiomas of infancy, in Pediatr Dermatol, vol. 30, n. 2, 2013, pp. 245–9, DOI:10.1111/j.1525-1470.2012.01723.x, PMID 22471694.
- ^ Guo S, Ni N, Topical treatment for capillary hemangioma of the eyelid using beta-blocker solution, in Arch. Ophthalmol., vol. 128, n. 2, 2010, pp. 255–6, DOI:10.1001/archophthalmol.2009.370, PMID 20142555.
- ^ Chakkittakandiyii A, Phillips R, Frieden IJ, Timolol maleate 0.5% or 0.1% gel-forming solution for infantile hemangiomas: a retrospective multicenter cohort study, in Pediatr Dermatol, vol. 29, n. 3, 2012, pp. 28–31, DOI:10.1111/j.1525-1470.2011.01664.x, PMID 22150436.
- ^ Pope E, Chakkittakandiyil A, Topical timolol gel for infantile hemangiomas: a pilot study, in Arch Dermatol, vol. 146, n. 5, 2010, pp. 564–5, DOI:10.1001/archdermatol.2010.67, PMID 20479314.
- ^ Greene AK, Management of hemangiomas and other vascular tumors, in Clin Plast Surg, vol. 38, n. 1, 2011, pp. 45–63, DOI:10.1016/j.cps.2010.08.001, PMID 21095471.
- ^ Rizzo C, Brightman L, Chapas AM, "Outcomes of childhood hemangiomas treated with the pulsed-dye laser with dynamic cooling " a retrospective chart analysis, in Dermatol Surg, vol. 35, n. 12, 2009, pp. 1947–54, DOI:10.1111/j.1524-4725.2009.01356.x, PMID 19889007.
- ^ David LR, Malek MM, Argenta LC, Efficacy of pulse dye laser therapy for the treatment of ulcerated haemangiomas: a review of 78 patients, in Br J Plast Surg, vol. 56, n. 4, 2003, pp. 317–27, DOI:10.1016/s0007-1226(03)00152-8, PMID 12873458.
- ^ Morelli JG, Tan OT, Weston WL, Treatment of ulcerated hemangiomas with the pulsed tunable dye laser, in Am J Dis Child, vol. 145, n. 9, 1991, pp. 1062–4, DOI:10.1001/archpedi.1991.02160090114036, PMID 1877568.
- ^ Garden JM, Bakus AD, Paller AS, Treatment of cutaneous hemangiomas by the flashlamp-pumped pulsed dye laser: prospective analysis, in J Pediatr, vol. 120, n. 4, 1992, pp. 555–60, DOI:10.1016/s0022-3476(05)82481-3, PMID 1552392.
- ^ Waner M, Suen JY, Dinehart S, Laser photocoagulation of superficial proliferating hemangiomas, in J Dermatol Surg Oncol, vol. 20, n. 1, 1994, pp. 43–6, DOI:10.1111/j.1524-4725.1994.tb03748.x, PMID 8288807.
- ^ Wahrman JE, Honig PJ, Hemangiomas, in Pediatr Rev, vol. 15, n. 7, 1994, DOI:10.1542/pir.15-7-266, PMID 8084847.
- ^ Couto RA, Maclellan RA, Zurakowski D, Greene AK, Infantile hemangioma: clinical assessment of the involuting phase and implications for management, in Plast Reconstr Surg, vol. 130, n. 3, 2012, DOI:10.1097/prs.0b013e31825dc129, PMID 22575857.
- ^ Stier MF, Glick SA, Hirsch RJ, Laser treatment of pediatric vascular lesions: Port wine stains and hemangiomas, in J Am Acad Dermatol, vol. 58, n. 2, DOI:10.1016/j.jaad.2007.10.492, PMID 18068263.
- ^ Brightman LA, Brauer JA, Terushkin V, Hunzeker C, Reddy KK, Weiss ET, Karen JK, Hale EK, Anolik R, Bernstein L, Geronemus RG, Ablative fractional resurfacing for involuted hemangioma residuum, in Arch Dermatol, vol. 148, n. 11, DOI:10.1001/archdermatol.2012.2346, PMID 22910902.
- ^ Bruckner AL, Frieden IJ, Hemangiomas of infancy, in J Am Acad Dermatol, vol. 48, n. 4, pp. 477–93, DOI:10.1067/mjd.2003.200, PMID 12664009.
- ^ Mulliken JB, Glowacki J, Classification of pediatric vascular lesions, in Plast Reconstr Surg, vol. 70, n. 1, DOI:10.1097/00006534-198207000-00041, PMID 7089103.
- ^ a b Wassef M, Blei F, Adams D, Alomari A, Baselga E, Berenstein A, Burrows P, Frieden IJ, Garzon MC, Lopez-Gutierrez JC, Lord DJ, Mitchel S, Powell J, Prendiville J, Vikkula M, Vascular Anomalies Classification: Recommendations From the International Society for the Study of Vascular Anomalies. ISSVA Board and Scientific Committee, in Pediatrics, vol. 136, n. 1, DOI:10.1542/peds.2014-3673, PMID 26055853.
- ^ North PE, Waner M, James CA, Mizeracki A, Frieden IJ, Mihm MC, Jr. Congenital nonprogressive hemangioma: a distinct clinicopathologic entity unlike infantile hemangioma, in Arch Dermatol, vol. 137, n. 12, DOI:10.1001/archderm.137.12.1607, PMID 11735711.
- ^ Leon-Villapalos J, Wolfe K, Kangesu L, GLUT-1: an extra diagnostic tool to differentiate between haemangiomas and vascular malformations, in Br J Plast Surg, vol. 58, n. 3, DOI:10.1016/j.bjps.2004.05.029, PMID 15780229.