Osteoclasto
| Osteoclasta | |
|---|---|
 | |
| Nome latino | osteoclastus |
| Sistema | sistema scheletrico |
| Identificatori | |
| MeSH | A11.627.482.700 |
| FMA | 66781 |
| TI | H2.00.03.7.00005 |
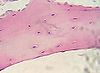
L'osteoclasto (o osteoclasta) è una cellula molto grande (dal diametro di 20/100 µm), polinucleata (sincizio, con circa una decina di nuclei) e ricca di lisosomi. Appartiene alla linea dei monociti-macrofagi, deriva cioè dalla cellula mesenchimale emopoietica. Presenta molte estroflessioni ed increspature nella membrana plasmatica, in posizione basale, chiamato orletto striato (o orletto increspato o arruffato). Nelle fessure tra i prolungamenti, ma mai nell'interno delle cellule, sono spesso visibili particelle minerali (cristalli di idrossiapatite), derivanti dalla lisi dell'osso, e talvolta anche microfibrille di collagene. Gli osteoclasti vanno a contatto con la matrice ossea e hanno la funzione di riassorbire l'osso erodendolo mediante enzimi di esocitosi e pH acido, collaborano cioè all'omeostasi calcica. Tutto ciò può essere fatto per riparare ad esempio una frattura.
Fin dal 1873, Köllicher aveva considerato gli elementi polinucleati dell'osso, come cellule deputate a riassorbire il tessuto e li definì perciò col termine di osteoclasti.
Appaiono spesso accolti in fossette scavate sulla superficie della trabecola ossea, definite lacune di Howship, che si formano a seguito della loro stessa attività erosiva.
Gli osteoclasti sono facilmente riconoscibili non solo per le grandi dimensioni, ma anche per l'elevata acidofilia citoplasmatica e per la forte positività alla reazione istochimica per la fosfatasi acida, determinata dall'elevato numero di lisosomi presenti. Uno di questi enzimi lisosomiali, la fosfatasi acida tartrato resistente (TRAP), è considerato un marcatore degli osteoclasti ed è utilizzato nella diagnostica clinica come parametro di attività osteoclastica rilevabile da un'analisi del sangue. La microscopia elettronica rivela la presenza nel citoplasma di numerosi mitocondri, complessi di Golgi, scarsi elementi di reticolo endoplasmatico rugoso, ma molti poliribosomi liberi.[1][2]
Riassorbimento osseo
[modifica | modifica wikitesto]Questa attività degli osteoclasti è svolta in tre fasi: l'adesione alla matrice ossea da riassorbire, la creazione di un ambiente acido che solubilizza la matrice minerale, la digestione enzimatica della matrice organica.
- L'adesione alla matrice da erodere avviene attraverso recettori integrinici ed è seguita dalla comparsa di podosomi, strutture di adesione che hanno la duplice funzione di isolare il microambiente che si trova ventralmente all'osteoclasto, in cui si svolgerà la funzione erosiva, e di fungere da strutture di trasmissione dei segnali extracellulari che danno origine al processo di riassorbimento osseo. L'osteoclasto si affaccia sulla matrice da riassorbire dal lato dell'orletto striato.
- Una anidrasi carbonica (anidrasi carbonica di tipo II) trasforma anidride carbonica e acqua in ione bicarbonato e protoni, nel citosol. Lo ione bicarbonato viene scambiato con Cloro. Cloro e protone vengono portati nello spazio delimitato dall'anello del podosoma grazie ad una pompa protonica (H+-ATPasi), situata nella membrana dell'orletto arruffato.
- Una pompa protonica situata nella membrana dell'orletto striato acidifica lo spazio extracellulare delimitato dall'anello di podosomi, si viene così a creare un pH di 4.5 che solubilizza i sali minerali. Tale fenomeno avviene tramite il rilascio di diversi enzimi, tra cui una proteasi lisosomiale collagenolitica specifica esclusivamente degli osteoclasti (la catepsina K).
- A questo punto la matrice organica è libera e avviene la degradazione enzimatica, tramite il rilascio di enzimi lisosomiali. I prodotti della degradazione della matrice organica vengono endocitati e poi riesocitati dalla parte opposta della cellula (transcitosi).
Dissoluzione componente organica
[modifica | modifica wikitesto]Vengono esocitate idrolasi acide dai lisosomi, che dissolvono la sostanza anista, grazie all’ambiente acido che vengono a trovare. Per dissolvere le fibre collagene c’è azione combinata con gli osteoblasti: le fibre collagene vengono distrutte dall'enzima collagenasi, che viene rilasciata in maniera inattiva e viene attivata dall’attivatore tissutale del plasminogeno(rilasciato da osteoblasti e osteclasti). Il plasminogeno viene tagliato a plasmina, che va ad attivare la collagenasi, che distrugge la componente fibrosa del collagene.
Origine degli osteoclasti
[modifica | modifica wikitesto]I precursori diretti degli osteoclasti sono i preosteoclasti, che circolano nel sangue e hanno, a loro volta, come precursore, un monocita.
L'origine degli osteoclasti è stata oggetto di una lunga controversia scientifica, che è terminata con il riconoscimento che gli osteoclasti derivano dalla cellula staminale emopoietica, e che il loro precursore immediato appartiene alla linea monocito-macrofagica. Più precisamente, gli osteoclasti sono sincizi derivanti dalla fusione di tali cellule. A questa conclusione di è giunti sia indirettamente, attraverso uno studio delle somiglianza recettoriali e funzionali tra macrofagi e osteoclasti, sia attraverso lo studio di una rara malattia genetica, l'osteopetrosi, sia infine direttamente attraverso la dimostrazione che in appropriate condizioni di coltura i macrofagi possono trasformarsi in osteoclasti. Partendo dall'osservazione che il differenziamento in vitro dei macrofagi in osteoclasti richiedeva il contatto fisico con osteoblasti o con cellule stromali del midollo osseo, si dimostrò che gli osteoblasti e le cellule stromali del midollo osseo producevano CSF-1 e RANKL. CSF-1 è una citochina che può essere sia secreta, sia inserita sul plasmalemma ed è in grado di stimolare il differenziamento e la proliferazione dei macrofagi a seguito del legame al suo recettore presente sul plasmalemma di queste cellule; anche RANKL è una proteina sia secreta, che transmembrana, che si lega al suo recettore RANKL, presente sul plasmalemma dei monociti e degli osteoclasti e ne induce il differenziamento. Il segnale generato dall'interazione RANK-RANKL è fondamentale per il differenziamento e l'attività degli osteoclasti. L'importanza della segnalazione RANK-RANKL è stata confermata da recenti studi, in cui è stato dimostrato che durante processi infiammatori i linfociti T attivati possono produrre RANKL e causare eccessivo riassorbimento osseo. Questo meccanismo potrebbe essere la causa della perdita di massa ossea nell'osteoporosi, che molto spesso è associata a diverse patologie infiammatorie.[3]
Differenziamento
[modifica | modifica wikitesto]Il paratormone (PTH) stimola l'osteoclastogenesi in maniera indiretta, agendo cioè sugli osteoblasti. Questi ultimi sotto l'influenza del PTH secernono una citochina, la M-CSF, per la quale i monociti possiedono un recettore specifico, il c-fms. Inoltre, sempre stimolati dal PTH gli osteoblasti secernono una proteina chiamata RANKL, per la quale i monociti possiedono il recettore specifico RANK. Queste molecole prodotte dagli osteoblasti interagiscono quindi con i monociti, inducendoli a differenziare in osteoclasti. Infine gli osteoblasti per mitigare l'azione di RANKL secernono un finto recettore solubile, chiamato osteoprotegerina (OPG), che legandosi a RANKL, ne impedisce l'interazione con il corretto recettore (RANK) presente, come detto, sulla superficie dei monociti. L'equilibrio fra la produzione di RANKL, M-CSF e OPG stabilisce il livello di osteoclastogenesi.
Inibizione
[modifica | modifica wikitesto]L'ormone calcitonina, prodotto dalla tiroide, inibisce l'attività degli osteoclasti, agendo direttamente su di essi.
Note
[modifica | modifica wikitesto]- ^ S. Adamo, M. De Felici, A. Dolfi, A. Filippini, M. Grano, A. Musarò, C. Nervi, G.Papaccio, A. Salustri, E. Ziparo, Istologia di Monesi, VII Edizione, Piccin, 2019, p. 467.
- ^ Maria Grazia Bottone, Marco Biggiogera, Citologia e Istologia, UTET, 2020, p. 386.
- ^ S. Adamo, M. De Felici, A. Dolfi, A. Filippini, M. Grano, A. Musarò, C. Nervi, G.Papaccio, A. Salustri, E. Ziparo, Istologia di Monesi, VII Edizione, Piccin, 2019, pp. 468-469.
Bibliografia
[modifica | modifica wikitesto]- S. Adamo, M. De Felici, A. Dolfi, A. Filippini, M. Grano, A. Musarò, C. Nervi, G.Papaccio, A. Salustri, E. Ziparo, Istologia di Monesi, VII Edizione, Piccin, 2019
- Maria Grazia Bottone, Marco Biggiogera, Citologia e Istologia UTET 2020
- Gennaro Goglia, Citologia e Istologia, Piccin 1999
- Roberto Colombo, Citologia e Istologia concetti base, Edi. Ermes, 2001
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «osteoclasto»
Wikizionario contiene il lemma di dizionario «osteoclasto» Wikimedia Commons contiene immagini o altri file su osteoclasto
Wikimedia Commons contiene immagini o altri file su osteoclasto
Collegamenti esterni
[modifica | modifica wikitesto]- osteoclasta, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) osteoclast, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 37906 · LCCN (EN) sh90003255 · GND (DE) 4246713-5 · BNF (FR) cb13185938s (data) · J9U (EN, HE) 987007529893805171 |
|---|
| Controllo di autorità | Thesaurus BNCF 37906 · LCCN (EN) sh90003255 · GND (DE) 4246713-5 · BNF (FR) cb13185938s (data) · J9U (EN, HE) 987007529893805171 |
|---|